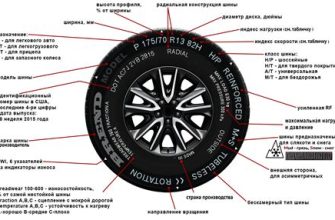
Диссоциация - это процесс разделения соединения на ионы или молекулы. В химии диссоциация является важным явлением, которое происходит при растворении вещества в жидкости или при нагревании твёрдого соединения. Диссоциированные ионы или молекулы могут образовывать электролитическое или неэлектролитическое растворы.
Принципы диссоциации могут быть разными в зависимости от типа соединения. Например, при диссоциации солей, происходит распад их кристаллической решетки на ионы положительного и отрицательного заряда. При диссоциации кислот или щелочей, происходит образование ионов водорода (H+) или гидроксидных ионов (OH-).
Пример диссоциации соли: NaCl → Na+ + Cl-
Диссоциация также может происходить при нагревании твёрдого соединения. Например, при нагревании гидроксида аммония (NH4OH) происходит диссоциация на аммиак (NH3) и воду (H2O).
Знание принципов диссоциации в химии является важным для понимания поведения вещества в различных условиях. Оно помогает в изучении свойств растворов, а также является основой для понимания процессов, происходящих в органической и неорганической химии.
Что такое диссоциация в химии?

Диссоциация – важное понятие в химии, которое обозначает разделение молекулы вещества на ионы или радикалы под влиянием внешних факторов, таких как температура или растворитель.
Когда молекула диссоциирует, она распадается на частицы, которые имеют электрический заряд и могут двигаться независимо друг от друга. Такие частицы называют ионами, положительно заряженные ионы называют катионами, а отрицательно заряженные - анионами.
Процесс диссоциации может происходить в различных состояниях вещества:
- В растворах: когда вещество полностью растворяется в растворителе и образует ионы;
- В твердых веществах: когда в ответ на воздействие температуры молекулы или их группы начинают разделяться;
- В газах: при действии электрического тока происходит разложение молекул на ионы.
Процесс диссоциации может быть обратимым или необратимым. В случае обратимой диссоциации ионы, полученные из разделенных молекул, могут снова сливаться в молекулы. Необратимая диссоциация означает, что ионы не могут снова соединиться в молекулы, поэтому они остаются в виде отдельных частиц.
Примеры диссоциации в химии включают диссоциацию кислот и оснований в водном растворе, диссоциацию солей, полимеров и других химических соединений. Диссоциация является фундаментальным процессом, понимание которого позволяет ученым лучше понять химические реакции и свойства веществ.
Определение и основные принципы

Диссоциация представляет собой процесс, в результате которого молекулы или ионы расслаиваются на заряженные частицы под воздействием растворителя или высоких температур. В результате диссоциации образуются ионы или свободные радикалы, которые могут проявлять химическую активность.
Основные принципы диссоциации в химии:
- Электролиты и нэлектролиты: Вещества, способные диссоциировать и образовывать ионы при растворении в воде или плавлении, называются электролитами. Растворы электролитов проводят электрический ток, так как ионы обладают зарядом. Вещества, не образующие ионов и не проводящие электрический ток, называются нэлектролитами.
- Степень диссоциации: Показатель, характеризующий долю диссоциированных молекул или ионов в растворе, называется степенью диссоциации. Она определяется величиной равновесной константы реакции диссоциации и зависит от условий (температуры, давления, концентрации вещества).
- Бравистедовская диссоциация: Тип диссоциации, при котором происходит перенос протона от кислоты к основанию. В результате образуются ион водорода (H+) и соответствующий отрицательно заряженный ион. Примером может служить диссоциация соляной кислоты:
| Соляная кислота (HCl) | Диссоциация | |
|---|---|---|
| HCl | → | H+ + Cl- |
Примеры диссоциации в химии

Диссоциация в химии является важным процессом, который происходит в различных реакциях и влияет на химические свойства веществ. Вот несколько примеров диссоциации:
- Диссоциация кислот:
Когда кислоты растворяются в воде, они диссоциируют на ионы, что позволяет им проявлять кислотные свойства. Примеры включают диссоциацию соляной кислоты (HCl) на ионы водорода (H+) и хлорида (Cl-) и диссоциацию уксусной кислоты (CH3COOH) на ионы водорода (H+) и ацетата (CH3COO-).
- Диссоциация щелочей:
Щелочи, такие как натриевая гидроксид (NaOH) и калиевая гидроксид (KOH), также диссоциируют в воде на ионы гидроксида (OH-) и соответствующие металлические ионы, такие как натрий (Na+) и калий (K+).
- Диссоциация солей:
Соли, такие как хлорид натрия (NaCl) и сульфат меди (II) (CuSO4), диссоциируют в воде на ионы, которые обычно имеют положительный и отрицательный заряды. Например, хлорид натрия диссоциирует на ионы натрия (Na+) и хлорида (Cl-).
- Диссоциация газов:
Некоторые газы, такие как хлороводородный газ (HCl) и аммиак (NH3), могут диссоциировать в растворах. Например, хлороводородный газ диссоциирует на ионы водорода (H+) и хлорида (Cl-), а аммиак диссоциирует на ионы аммония (NH4+) и гидроксида (OH-).
Это лишь несколько примеров диссоциации в химии. Диссоциация является важным процессом, который помогает нам понять свойства веществ и их реакционную способность.