Гальванический элемент – это электрохимический устройство, способное преобразовать химическую энергию в электрическую. В основе работы гальванического элемента лежит разность потенциалов между электродами, которая вызывается какими-то внешними факторами. Однако, для того чтобы гальванический элемент мог функционировать эффективно, необходимо понимать, от чего зависит его напряжение и какие факторы оказывают на это влияние.
Первым и основным фактором, определяющим напряжение гальванического элемента, является химическая реакция, происходящая между электродами. Чаще всего используются металлы, которые обладают разной электрохимической активностью. Это позволяет иметь различные потенциалы окисления и восстановления, которые в результате формируют электродную разность потенциалов.
Однако на напряжение гальванического элемента также оказывают влияние такие факторы, как концентрация растворов электролита, температура среды, площадь электродов, длина электролитической ячейки и другие.
Таким образом, для достижения высокого напряжения гальванического элемента необходимо обратить внимание на все вышеперечисленные факторы и выяснить, как они взаимодействуют друг с другом. Только тщательный анализ и учет всех факторов позволят достичь желаемых результатов.
Реакции, происходящие в гальваническом элементе

Напряжение гальванического элемента зависит от химических реакций, происходящих в его составе. Гальванический элемент состоит из двух полуделей, которые называются полюсами: анодом и катодом. Анод - это место окисления, где происходит потеря электронов, а катод - место восстановления, где происходит приобретение электронов.
Реакции, происходящие на аноде и катоде, могут быть представлены следующим образом:
| Полюс | Реакция |
|---|---|
| Анод | Окисление материала анода, при котором выделяются электроны |
| Катод | Восстановление материала катода, при котором поглощаются электроны |
Реакции, происходящие на аноде и катоде, связаны друг с другом и образуют электрохимическую реакцию. Электрохимическая реакция протекает через электролит, который является средой для переноса ионов между полюсами.
Реакции, происходящие в гальваническом элементе, могут быть описаны с помощью электродных потенциалов. Электродный потенциал - это мера тенденции электрода вступить в реакцию. Разность электродных потенциалов между анодом и катодом определяет напряжение гальванического элемента.
Таким образом, реакции, происходящие в гальваническом элементе, имеют ключевое значение для определения его напряжения. Понимание этих реакций помогает в изучении принципов работы гальванических элементов и разработке более эффективных источников электрической энергии.
Температура окружающей среды

Температура окружающей среды является одним из факторов, от которого зависит напряжение гальванического элемента. Изменение температуры может влиять как на скорость реакции внутри элемента, так и на процесс передачи электронов через электролит.
При повышении температуры, скорость реакций увеличивается, что влечет за собой повышение напряжения элемента. Это связано с тем, что увеличивается энергия частиц, что приводит к более активному их движению и столкновениям. Также, при повышении температуры увеличивается электропроводность электролита, что также способствует повышению напряжения гальванического элемента.
Однако, существуют исключения. Некоторые гальванические элементы, такие как элементы на основе лития или никеля, имеют обратную зависимость напряжения от температуры. При повышении температуры такие элементы могут давать меньшее напряжение. Причиной такого поведения могут быть процессы, связанные с изменением структуры материалов внутри элемента или изменением химических реакций.
Важно отметить, что экстремальные температуры могут иметь негативное воздействие на гальванический элемент. Высокая температура может привести к ускоренному старению элемента и снижению его емкости. Низкая температура, с другой стороны, может снижать эффективность реакций внутри элемента и его напряжение.
Таким образом, температура окружающей среды играет важную роль в работе гальванического элемента и может влиять как на его напряжение, так и на его долговечность.
Окислительно-восстановительный потенциал реагентов

Окислительно-восстановительный потенциал реагентов играет важную роль в определении напряжения гальванического элемента. Наиболее значимыми факторами являются окислительное и восстановительное свойства веществ, которые вступают в реакцию.
Окислитель – это вещество, способное принять электроны от другого вещества и при этом само уменьшается. Восстановитель – это вещество, которое отдаёт электроны другому веществу и при этом само окисляется.
Окислительно-восстановительный потенциал (ОВП) реагентов определяется их способностью принимать или отдавать электроны. ОВП измеряется в вольтах и является мерой силы окислительно-восстановительной реакции.
Если окислительное вещество обладает высоким ОВП, оно имеет большую способность принимать электроны и окислять восстановительное вещество. Соответственно, восстановительное вещество будет иметь низкий ОВП и отдавать свои электроны окислителю.
При реакции окисления и восстановления электроны переходят от восстановителя к окислителю через внешнюю цепь электрического контура. В данном контуре образуется различие потенциалов, что и приводит к возникновению электрического тока.
В случае гальванического элемента, где окислитель и восстановитель разделены, разность окислительно-восстановительного потенциала обеспечивает энергию, отделяющуюся в виде электрического тока.
Концентрация растворов реагентов

Одним из факторов, влияющих на напряжение гальванического элемента, является концентрация растворов реагентов. Концентрация означает количество вещества, растворенного в единице объема или массы растворителя.
Изменение концентрации растворов реагентов может существенно влиять на скорость химической реакции и, следовательно, на напряжение гальванического элемента. Важно отметить, что концентрация анодного и катодного растворов может быть разной.
Концентрация растворов реагентов оказывает влияние на перенос электронов и их процесс окисления и восстановления. При увеличении концентрации реагентов повышается вероятность встречи молекул для процесса окисления-восстановления. Это увеличение вероятности способствует увеличению скорости химической реакции и, соответственно, увеличению напряжения гальванического элемента.
Однако увеличение концентрации реагентов может вызвать и противоположный эффект. При высокой концентрации ионов в растворе может происходить более интенсивное выделение газовых пузырьков на электроде, что может затруднить процесс переноса электронов и уменьшить скорость реакции. В результате это может привести к снижению напряжения гальванического элемента.
Таким образом, оптимальная концентрация растворов реагентов является важным фактором, который следует учитывать при проектировании и использовании гальванического элемента. Конкретные значения концентрации будут зависеть от типа реагентов, применяемых в элементе, и требуемого уровня напряжения.
Внешнее сопротивление цепи

Внешнее сопротивление цепи является одним из факторов, которые влияют на напряжение гальванического элемента. Внешнее сопротивление представляет собой сопротивление, которое подключено к цепи гальванического элемента.
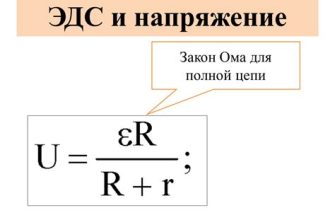
Влияние внешнего сопротивления на напряжение гальванического элемента проявляется через закон Ома. Согласно этому закону, напряжение в цепи прямо пропорционально величине тока и сопротивлению внешней цепи. Таким образом, при увеличении внешнего сопротивления, напряжение гальванического элемента уменьшается, и наоборот.
Внешнее сопротивление может быть как физическим сопротивлением подключенных элементов (например, лампочки, провода), так и сопротивлением самой цепи гальванического элемента.
Важно отметить, что у разных типов гальванических элементов есть определенное внутреннее сопротивление, которое также влияет на напряжение элемента. Внутреннее сопротивление можно рассматривать как сопротивление источника электрической энергии. Таким образом, внешнее сопротивление цепи и внутреннее сопротивление гальванического элемента вместе определяют конечное значение напряжения.
Изменение внешнего сопротивления цепи может быть использовано в практике для регулирования и управления напряжением гальванического элемента. Например, в некоторых случаях желательно иметь низкое напряжение, для чего используют большое внешнее сопротивление, а в других случаях требуется высокое напряжение, поэтому внешнее сопротивление минимально.
Электродный потенциал электродов

Электродный потенциал - это мера способности электрода к окислению или восстановлению при участии в электрохимической реакции. Он определяется разностью потенциалов между электродом и стандартным водородным электродом при температуре 25°С и концентрации раствора 1 М. Электродный потенциал может быть положительным или отрицательным в зависимости от того, в каком направлении происходит реакция на электроде.
Электродный потенциал зависит от ряда факторов, включая:
- Химической природы электрода: разные вещества имеют разные способности к окислению и восстановлению. Например, металлы обычно имеют низкий электродный потенциал, а неметаллы - высокий.
- Концентрации ионов в растворе: концентрация ионов влияет на скорость реакции и, следовательно, на электродный потенциал. Повышенная концентрация ионов может привести к увеличению электродного потенциала.
- Температуры: температура также оказывает влияние на электродный потенциал. Возрастание температуры может привести к увеличению электродного потенциала.
- Другие факторы, такие как давление и состояние поверхности электрода, также могут влиять на электродный потенциал.
Электродный потенциал важен для понимания и изучения электрохимических реакций и для разработки электрохимических устройств, таких как батареи и гальванические элементы.
| Электрод | Потенциал (В) |
|---|---|
| Литий | +3.05 |
| Цинк | +0.76 |
| Железо | +0.44 |
| Водород | +0.00 |
| Медь | -0.34 |
| Серебро | -0.80 |
| Золото | -1.50 |
Эти значения электродных потенциалов могут быть использованы для расчета ЭДС гальванического элемента или напряжения батареи.
Вопрос-ответ

От чего зависит напряжение гальванического элемента?
Напряжение гальванического элемента зависит от различных факторов, включая химический состав электродных материалов, концентрацию электролита, температуру, площадь поверхности электродов и их удаленность друг от друга.
Как химический состав электродных материалов влияет на напряжение гальванического элемента?
Химический состав электродных материалов определяет разницу в электрохимическом потенциале между ними, что в свою очередь влияет на напряжение гальванического элемента. Так, разница в потенциалах между электродами разных материалов может создавать электрическую силу, которая может быть использована для привода электрических устройств.
Какие еще факторы могут влиять на напряжение гальванического элемента?
Помимо химического состава электродных материалов, напряжение гальванического элемента может быть affected концентрацией электролита - разница в концентрации раствора вокруг электродов может влиять на скорость реакций на электродах и тем самым изменять напряжение. Также температура играет роль: чем выше температура, тем быстрее протекают реакции и выше может быть напряжение гальванического элемента. Поверхность электродов и их удаленность друг от друга также могут влиять на напряжение.